細胞の直接変換を誘導する低分子化合物の
組み合わせを予測するAIを開発
― 生体ビッグデータと最適化アルゴリズムを活用した再生医療の開拓 ―
九州工業大学大学院情報工学研究院の山西芳裕教授らの研究グループは、国立研究開発法人産業技術総合研究所安全科学研究部門の竹下潤一主任研究員との共同研究により、iPS細胞のような未分化細胞を介さずに、すでに分化した細胞を別の種類の細胞へと直接変換するダイレクトリプログラミングを誘導する低分子化合物※1を予測するAIを開発しました。
ポイント
- すでに分化した細胞を別の種類の細胞へと直接変換するダイレクトリプログミングを誘導する低分子化合物を予測するAIを開発した。
- 細胞の直接変換が誘導される分子メカニズムを考慮することで、低分子化合物の最適な組み合わせを予測可能なアルゴリズム※2を開発した。
- 開発した手法は任意の細胞変換に適用でき、今後の再生医療分野における細胞治療法の安全性の向上に繋がることが期待される。
本研究グループは、すでに分化した細胞を別の種類の細胞へと直接変換するダイレクトリプログラミングを誘導する低分子化合物を予測するAIを開発しました。通常の細胞の直接変換は、ウイルスを用いて必要な遺伝子を元細胞に導入するため、ウイルスに起因する発がんリスクなどの問題がありました。そこで遺伝子導入の代わりに低分子化合物の添加による細胞変換を誘導する技術が切望されていますが、実験的に低分子化合物を同定するのは時間や実験コストの面から極めて困難です。そこで、本研究グループは、細胞の直接変換を誘導する低分子化合物を予測する最適化アルゴリズムを開発しました。まず、細胞が変換する分子メカニズムに着目し、変換過程で重要な生物学的パスウェイ※3を明らかにしました。次いで、その生物学的パスウェイを制御する低分子化合物の最適な組み合わせを探索することによって、細胞の直接変換を誘導する低分子化合物の新たな組み合わせを予測する手法の確立に成功しました。本開発手法によって、細胞の直接変換を誘導する低分子化合物を簡便に予測することができるようになり、今後の再生医療分野における細胞作製法の安全性の向上を促進することが期待されます。
本研究成果は、2022年9月19日に英国科学誌Bioinformaticsで公開されます。研究の詳細は別紙をご参照ください。
<研究の背景と経緯>
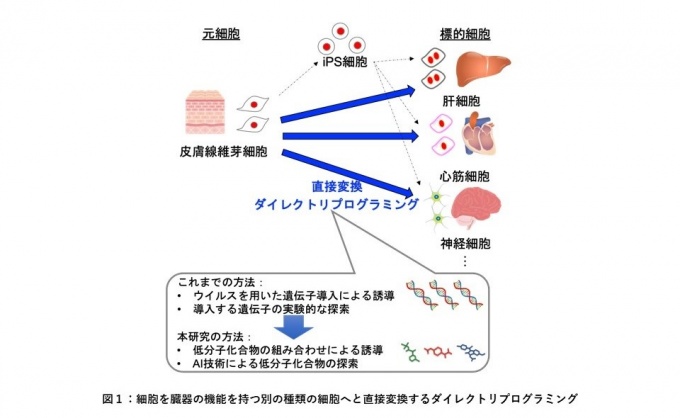
ダイレクトリプログラミング(細胞の直接変換)は、iPS 細胞のような未分化の細胞を介さずに、すでに分化した細胞を別の種類の細胞に直接変換する技術です。iPS細胞を経由した細胞の作製法より短期間で低コストに細胞を作製できることから、将来の再生医療を担う革新的な技術として注目されています。しかし、従来の細胞の直接変換は、ウイルスを用いて必要な遺伝子を元細胞に導入するため、ウイルスに起因する発がんリスクなどの問題がありました。そこで近年では、発がんリスクを回避するため、低分子化合物(薬剤や化学物質など)の添加による細胞の直接変換が切望されています(図1)。
細胞の直接変換を誘導する低分子化合物の最適な組み合わせを実験的に同定することは多くの実験コストがかかり、極めて困難です。また低分子化合物による細胞の直接変換のメカニズムは不明であり、添加すべき低分子化合物の数が多ければ、臨床応用の際に重篤な副作用に繋がる可能性が高まります。そのため、低分子化合物を用いた細胞の直接変換のメカニズムの解明や少ない低分子化合物での誘導が求められます。しかしながら、細胞の直接変換の分子生物学的メカニズムに基づいて低分子化合物を予測する手法は未だに確立されていませんでした。
<研究の内容>
九州工業大学大学院情報工学府大学院生(当時)の中村透、江口凌平、大学院情報工学研究院の岩田通夫准教授、濱野桃子助教、山西芳裕教授らの研究グループは、国立研究開発法人産業技術総合研究所安全科学研究部門の竹下潤一主任研究員との共同研究により、細胞の直接変換を誘導する低分子化合物を予測する世界初のAI手法を開発しました。
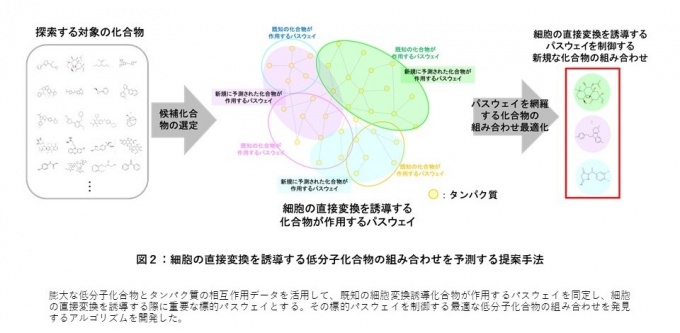
本研究では、膨大な低分子化合物とタンパク質の相互作用データを基に、細胞変換に関連している生物学的パスウェイを推定しました。次いで、細胞変換に関わる生物学的パスウェイを効率的に制御できるように組み合わせを最適化し、細胞の直接変換を誘導する低分子化合物の新たな組み合わせを予測するアルゴリズムを開発しました(図2)。
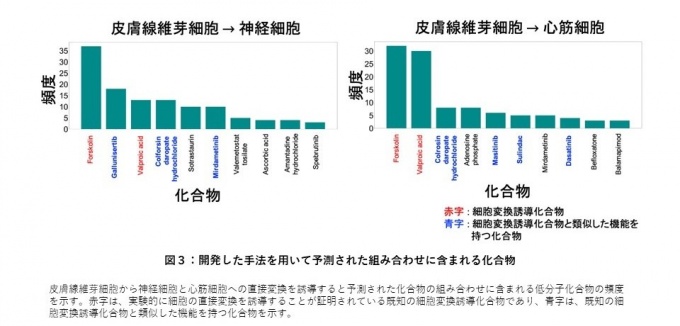
今回開発した手法を用いて、皮膚線維芽細胞から神経細胞や心筋細胞への直接変換を誘導する低分子化合物の組み合わせを予測しました(図3)。その結果、細胞の直接変換を誘導することが証明されている既知の低分子化合物を含む組み合わせを高い頻度で再現することが確認できました。また、既知の細胞変換誘導化合物だけでなく、既知の細胞変換誘導化合物と類似した機能を持つ低分子化合物も多く含まれていました。このことから、本開発手法は細胞の直接変換を誘導するために重要な低分子化合物を含む新規な組み合わせを予測できることを示しました。
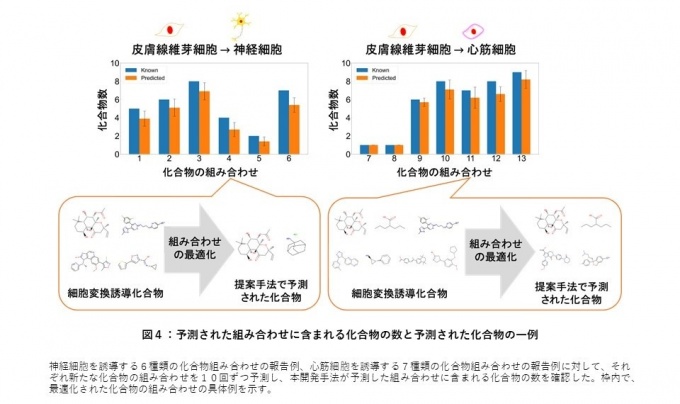
次いで、本開発手法により予測された組み合わせを構成する低分子化合物の個数を確認しました(図4)。皮膚線維芽細胞から神経細胞を誘導する6例の既知の化合物組み合わせ及び心筋細胞を誘導する7例の既知の化合物組み合わせに対して、代替となる新たな化合物組み合わせを予測しました。その結果、全ての報告例に対して、予測された化合物の個数は既知の化合物の個数より少なくすることができました。例えば、神経細胞を誘導することが知られている4つの化合物の組み合わせに代わる化合物として、2つの化合物からなる新たな組み合わせが予測されました(図4左)。また、心筋細胞を誘導することが知られている7つの化合物の組み合わせに代わる化合物として、4つの化合物からなる新たな組み合わせが予測されました(図4右)。このことから、本開発手法は既知の組み合わせよりも少ない最適な化合物の組み合わせを予測できることが示唆されました。このことは、化合物の数が多くなると交互作用による副作用の可能性が高まるため、少ない化合物での細胞変換は安全性の向上に繋がることが期待されます。
<今後の展開>
本研究では、細胞の直接変換を誘導する低分子化合物の組み合わせを予測するAIを開発しました。本開発手法は、これまでに不明であった低分子化合物による細胞の変換過程における重要な生物学的パスウェイを同定する点が特長であり、また、そのパスウェイ情報を活用して低分子化合物の組み合わせを最適化アルゴリズムで予測する先駆的な情報技術です。
本開発手法は、細胞の変換過程で制御されるパスウェイのリストがあれば、心筋細胞や神経細胞以外の細胞変換へ応用することができます。そのため、細胞の直接変換を誘導する方法が転写因子※4のみしか報告されていない細胞種に対しても適用することができ、細胞の直接変換に必要な転写因子に代わる低分子化合物を予測することも可能です。このことから、本研究は再生医療における細胞治療法の安全性向上への貢献に繋がることが期待されます。今後は、様々な細胞変換に対して予測した化合物の組み合わせを実験検証し、その有用性を確認していく予定です。
本研究は、日本学術振興会?科学研究費助成事業?挑戦的研究(萌芽)(JP18K19930)における研究課題「低分子化合物による転写因子制御と細胞直接変換のためのインシリコ予測法の開発」(研究代表者:山西芳裕)、挑戦的研究(開拓)(JP21K18327)「AIによるデータ駆動型ダイレクトリプログラミングの創生と腫瘍化リスクの回避」(研究代表者:山西芳裕)の支援を受け行われました。
【用語説明】
※1 低分子化合物:分子量が小さい化合物のこと。特定の生体分子(タンパク質など)に結合し、その機能を阻害もしくは活性化する分子標的薬なども含む。
※2 組み合わせ最適化アルゴリズム:様々な制約の下で多くの選択肢の中から、ある指標をもっともよくする変数の値(組み合わせ)を求めること。例えば焼きなまし法などがある
※3 生物学的パスウェイ:遺伝子やタンパク質の機能的な連動を経路として表したもの。代謝や遺伝子の制御関係、シグナル伝達系などの様々な種類のパスウェイが存在する。
※4 転写因子:DNA に結合して遺伝子の発現を調節するタンパク質。様々な転写因子を細胞に導入することで標的の遺伝子を発現調節することができる。
■ 発表雑誌
| 論文タイトル | “Small compound-based direct cell conversion with combinatorial optimization of pathway regulations” |
| 著者 | Nakamura, T., Iwata, M., Hamano, M., Eguchi, R., Takeshita J., and Yamanishi, Y. |
| 雑誌名 | 「Bioinformatics」(オンライン版:2022年9月19日) |
| DOI | 10.1093/bioinformatics/btac475 |
【お問い合わせ】
九州工業大学大学院情報工学研究院
生命化学情報工学研究系
教授 山西芳裕
TEL: 0948-29-7821
E-mail: yamani*bio.kyutech.ac.jp
(メールは*を@に変えてお送りください)