生体分子と疾患のビッグデータから
治療標的分子を高精度で予測するAIを開発
― 疾患横断解析による新規の治療標的の創出へ ―
九州工業大学大学院情報工学研究院の山西芳裕教授らの研究グループは、生体分子と疾患の遺伝子発現データから、多様な疾患に対し治療標的分子(薬剤で制御することで疾患の治療に繋がる生体分子)を高精度で予測する機械学習手法を開発しました。
ポイント
- 従来手法では膨大な生体分子の中から治療標的分子を選ぶのが困難だったが、高精度で予測できる機械学習手法を開発した。
- 多様な疾患に対して、各生体分子が治療標的となる可能性を予測するターゲットリポジショニングの概念を提案した。
- 既存の治療標的分子の転用や新規の治療標的分子の創出により医薬品開発の促進が期待される。
医薬品開発において、治療標的分子(薬剤で制御することで疾患の治療に繋がる生体分子)を同定することは重要課題です。しかし、既存の病理学的知識から推測できる治療標的分子は限定されており、治療標的分子の枯渇が世界的な課題となっています。
本研究では、既存の薬剤を新しい疾患に転用するドラッグリポジショニングの概念を治療標的分子へと拡張することで、既存の治療標的分子を新しい疾患に転用するターゲットリポジショニングの概念を提案しました。提案手法は、治療標的分子の細胞応答を反映する遺伝子発現パターンと疾患特異的な遺伝子発現パターンの融合解析により、疾患横断的に治療標的分子を予測する機械学習手法を開発しました。遺伝子配列の変異情報に依存した従来手法では、疾患治療に向けて阻害すべき治療標的分子と活性化すべき治療標的分子を分けて予測することが困難でしたが、遺伝子発現情報を用いることで両者の識別を可能にしました。また、疾患間で類似する発症メカニズムを考慮することで、従来の手法と比較して治療標的分子を高い精度で予測することが可能となりました。
提案手法は既存の治療標的分子だけでなく未開発の生体分子に対しても治療標的分子としての治療可能性を予測できるため、既存の治療標的分子の転用や新規の治療標的分子の創出による、医薬品開発の促進が期待されます。
なお、本研究成果は、2022年6月27日に国際科学雑誌「Bioinformatics」のオンライン版で公開されました。
<研究の背景と経緯>
医薬品開発において、薬剤により制御すると疾患の治療に繋がる生体分子である治療標的分子の同定は重要課題です。治療標的分子の同定は医薬品開発の最初の過程に相当するため、不適切な治療標的分子を選択すると医薬品開発の成功率に大きな影響を及ぼします。しかし、既存の病理学的知識から推測できる治療標的分子は限定されており、治療標的分子の枯渇が世界的な課題となっています。
従来の探索手法では、遺伝子配列の変異の情報に基づき治療標的候補分子を選択していたため、候補となる生体分子が非常に多く疾患の治療に有効な治療標的分子を絞り込むのが困難でした。また、遺伝子配列の変異を持たないが疾患の病態メカニズムの観点から治療標的分子となる生体分子を見つけることはできませんでした。
治療標的分子は、活性化することで疾患の治療に繋がる活性化標的と、阻害することで疾患の治療に繋がる阻害標的に分けられます。従来手法では遺伝子変異の有無に依存していたため、阻害標的分子と活性化標的分子を区別した予測が困難でした。また、個々の疾患ごとに解析を行うのが一般的であり、医薬品開発に膨大な時間を要していました。そのため、膨大な生体分子の中から確実に疾患の治療に繋がる治療標的分子を、多様な疾患に対して予測できる情報技術の開発が求められています。
<研究の内容>
九州工業大学大学院情報工学府博士後期課程情報創成工学専攻1年の難波里子、岩田通夫研究職員、山西芳裕教授は、生体分子と疾患の遺伝子発現パターンから治療標的分子を高精度で予測する新たな機械学習手法を開発しました。
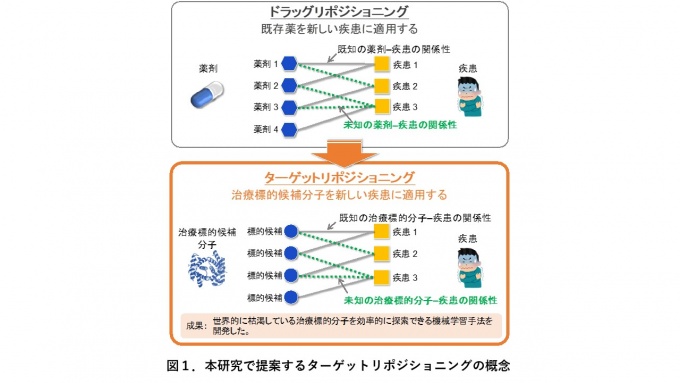
本研究では、既存の治療標的分子を新しい疾患に転用するターゲットリポジショニングを提案しています。疾患の治療薬探索においては、既存の薬剤を本来想定していた疾患とは異なる別の疾患へ転用するドラッグリポジショニング注1)という手法があります。本研究では、この概念を薬剤ではなく治療標的分子に適用したターゲットリポジショニングにより、既存の治療標的分子について新たな治療可能疾患の予測を行います(図1)。
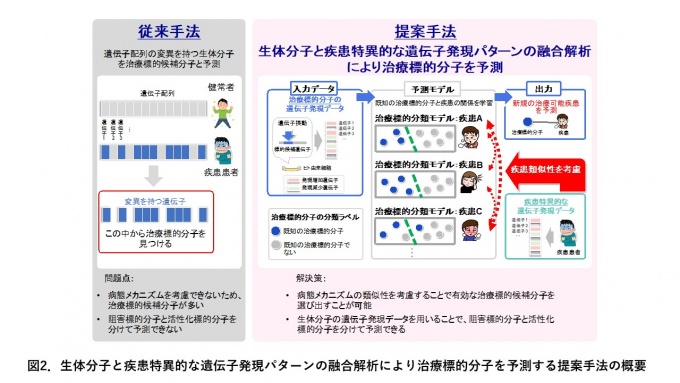
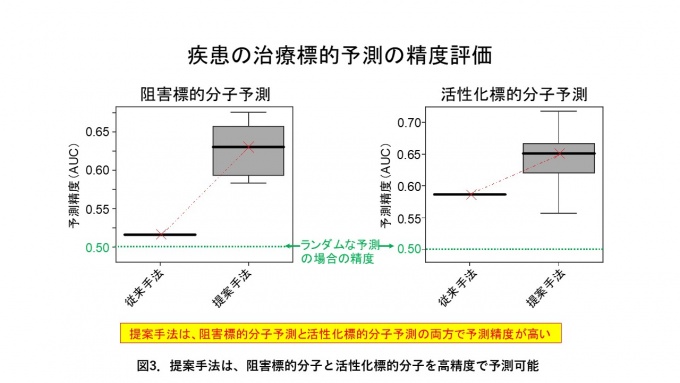
ヒト由来細胞において治療標的分子を遺伝子ノックダウン注2)または遺伝子過剰発現注3)させた際の遺伝子発現パターン(4,345個の阻害標的候補分子、3,114個の活性化標的候補分子)と疾患特異的な遺伝子発現パターン(79疾患)の融合解析により、阻害標的分子と活性化標的分子を区別して予測する機械学習手法を開発しました。各疾患に対して予測モデルを構築し、既知の治療標的分子と疾患の関係性を学習させました(図2)。既知の治療標的分子と疾患の関係データは非常に少なく、モデル構築における障害となっていましたが、予測モデル間で疾患病態メカニズムの類似性を共有することで、従来法より治療標的分子の予測精度を最大30%向上させることに成功しました(図3)。
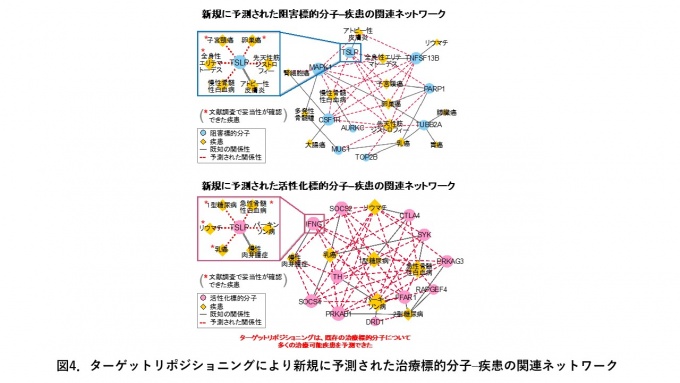
次に、開発手法を用いて既存の治療標的分子に対して、新たな治療可能疾患の予測を行いました。新規に予測された治療標的分子と疾患の関係性について検討したところ、文献調査や分子機能解析から予測の妥当性が示唆されました。慢性肉芽種症の活性化標的分子であるIFNGは、乳がんやI型糖尿病、リュウマチ、急性骨髄性白血病、パーキンソン病に対して転用できる可能性が予測され、うち4疾患において近年の文献から妥当性を確認することができました(図4)。
さらに、既存の治療標的分子だけでなく、治療標的分子として未開発の生体分子に対しても治療可能性を予測できるか検証しました。成人T細胞性白血病注4)に対する阻害標的分子として予測されたTAF1Bについて分子機能解析を行なったところ、成人T細胞性白血病の原因であるヒトT細胞白血病ウイルス1型(HTLV-1)感染注5)やカルシニューリン-NFATシグナル伝達経路注6)などの生体反応との関連が示唆されました。開発手法は既存の治療標的分子だけでなく疾患との関連が未知の生体分子に対しても治療可能性を予測できることが期待できます。
<今後の展開>
本研究では、さまざまな疾患に対して新規の治療標的分子を予測するターゲットリポジショニングという新たな概念を提案しました。開発手法は既存の治療標的分子だけでなく未開発の生体分子に対しても治療標的分子となり得る治療可能疾患を予測できるため、既存の治療標的分子の転用や新規の治療標的分子の創出により、さまざまな疾患に対する医薬品開発の促進が期待されます。
今後は、有効な治療標的分子が明らかになっていないような新型コロナウイルス感染症や難治性疾患に対して開発手法を適用することで、新規の治療標的分子の創出に繋げていく予定です。
<参考図>
ドラッグリポジショニングは疾患の治療薬探索に用いられる手法であり、既存の薬剤を本来想定していた疾患とは異なる別の疾患へ転用します。既存の薬剤は既に安全性が十分に評価されているため、効率的な創薬手法として知られています。本研究ではこの概念を薬剤ではなく治療標的分子に適用したターゲットリポジショニングを提案します。図はある治療標的分子が既知の治療可能疾患とは異なる別の疾患に対しても、治療標的分子となる可能性を示しています。ターゲットリポジショニングでは、既存の治療標的分子および未開発の生体分子を対象に新たな治療可能疾患の予測を行います。
従来手法では遺伝子配列の変異情報に基づき、変異を有する生体分子を治療標的候補分子として予測します。病態メカニズムを考慮できないため、膨大な生体分子の中から有効な治療標的分子を選び出すことが困難です。また、遺伝子変異の有無に依存するため、阻害標的分子と活性化標的分子を分けて予測することができません。本研究では、病態メカニズムの類似性を考慮することで有効な治療標的分子を選び出すことを容易にしました。また、治療標的分子の細胞応答を反映した遺伝子発現パターンと疾患特異的な遺伝子発現パターンの融合解析により、阻害標的分子と活性化標的分子を別々に予測することを可能にしました。
既存の治療標的分子を上位に予測できたかどうかで精度評価を行いました。左の図は阻害標的分子予測に対する精度評価、右の図は活性化標的分子予測に対する精度評価の結果です。予測精度(AUC)の値が1に近いほど、既存の治療標的分子を正確に予測できていることを表します。疾患間の類似性を考慮した提案手法は、従来の遺伝子配列の変異に基づく手法よりも、阻害標的分子と活性化標的分子を高精度で予測できることが分かりました。
開発手法を4,345個の阻害標的候補分子のタンパク質と3,114個の活性化標的候補分子のタンパク質に新規に適用し、新規に治療可能疾患を予測しました。図は、予測された治療標的分子と疾患の関連性を表すネットワークの一部を示しています。丸が治療標的分子、ダイヤが疾患、グレーの線が既知の関係性、赤の点線が新規に予測された関係性を表します。
【用語説明】
注1)ドラッグリポジショニング
既存薬を本来想定していた適用疾患とは異なる疾患に対し転用すること。既存薬は安価で安全性が十分確認されているため、ドラッグリポジショニングは効率的な創薬手法として注目されている。
注2)遺伝子ノックダウン
特定の遺伝子の発現量を減少させることで、遺伝子機能を抑制すること。
注3)遺伝子過剰発現
特定の遺伝子の発現量を増加させることで、遺伝子機能を活性化すること。
注4)成人T細胞性白血病
ヒトT細胞白血病ウイルス1型の感染により引き起こされる。末梢血に異常なリンパ球が出現し、全身の臓器に浸潤する血液腫瘍。血液腫瘍の中で最も予後不良の疾患であるため、有効な治療薬の開発が望まれる。
注5)ヒトT細胞白血病ウイルス1型(HTLV-1)感染
ヒトT細胞白血病ウイルス1型は成人T細胞性白血病を引き起こす。主要な感染経路は母子感染と性感染。
注6)カルシニューリン-NFATシグナル伝達経路
T細胞における遺伝子発現制御機構。免疫抑制剤の標的として知られる。
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業AIP加速研究(AIP加速PRISM研究*)における研究課題「創薬標的分子の確からしさを検証するツール物質の探索」(研究代表者:山西芳裕)、厚生労働科学研究費補助金(政策科学総合研究事業)における研究課題「新薬創出を加速する症例データベースの構築?拡充/創薬ターゲット推定アルゴリズムの開発」(研究分担者:山西芳裕)の研究の一環で行われました。
*本事業は、官民研究開発投資拡大プログラム(PRISM)の一環で行うものです。
■ 発表雑誌
| 論文タイトル | “From drug repositioning to target repositioning: prediction of therapeutic targets using genetically perturbed transcriptomic signatures” |
| 著者 | Namba, S., Iwata, M. and Yamanishi, Y. |
| 雑誌名 | 「Bioinformatics」(オンライン版:2022年6月27日) |
| DOI | 10.1093/bioinformatics/btac240 |
【研究内容に関するお問い合わせ】
九州工業大学大学院情報工学研究院
生命化学情報工学研究系
教授 山西芳裕
TEL: 0948-29-7821
E-mail: yamani*bio.kyutech.ac.jp
【報道に関するお問い合わせ】
九州工業大学広報課広報係
TEL: 093-884-3008
E-mail: sou-kouhou*jimu.kyutech.ac.jp
(メールは*を@に変えてお送りください)