コンピュータを使って相乗効果を持つ薬剤の組み合わせを予測する
― 生命と情報の協奏によるシナジー創薬学 ―
九州工業大学大学院情報工学研究院の飯田緑 准教授、徳島大学大学院医歯薬学研究部の合田光寛 准教授?石澤啓介 教授、名古屋大学大学院情報学研究科の山西芳裕 教授の研究グループは、国立研究開発法人産業技術総合研究所安全科学研究部門の竹下潤一 主任研究員との共同研究により、相乗効果のある薬剤の組み合わせを予測する計算手法を開発しました。
ポイント
- 疾患の治療効果を増強する薬剤の組み合わせを様々なビッグデータから論理的に予測できる新しい計算手法を開発した。
- 生体分子間相互作用ネットワークや遺伝子発現などのオミックス情報を統合することで、相乗効果を持つ薬剤の組み合わせを網羅的に予測することを可能にした。
- 提案手法は多くの疾患に対する効果的な薬剤の組み合わせの発見に寄与することが期待される。
複数の薬剤を組み合わせることにより、単独で使用した場合に比べて、副作用の軽減や治療効果の向上が期待されます。しかし、医薬品の数は膨大で、動物実験や臨床試験を用いて効果的な組み合わせを見つけるのは非常に困難です。このため、効果的な薬剤組み合わせを同定できる手法が切望されていました。
そこで本研究では、生体分子間相互作用ネットワークや遺伝子発現などのオミックス情報から、相乗効果を持つ薬剤の組み合わせを予測する計算手法を開発しました。生体内の分子は、単独で働くのではなく、他のさまざまな分子との相互作用によりその機能を発揮します。そこで、生体分子間相互作用ネットワークにおいて、疾患に関連するタンパク質群(疾患モジュール)と薬剤応答に関連するタンパク質群(薬剤モジュール)を同定しました。次に、ネットワーク伝播法を用いて、疾患モジュールと薬剤モジュールの位置関係?距離関係?相関関係を統合し予測スコアを計算しました。予測の精度を調べた結果、慢性骨髄性白血病などの6つの疾患において、従来の方法に比べて高い精度で薬剤組み合わせを予測できることが示されました。また、細胞生存実験により、慢性骨髄性白血病に対して予測された上位17の薬剤ペアのうち13のペアで相乗的な抗がん効果が確認されました。本手法は、がんを含む様々な疾患の治療において、効果的な薬剤組み合わせの発見に役立つと期待されます。
本研究成果は、2024年7月26日午後6時(日本時間)に Communications Medicineで公開されました。
■ 研究の背景と経緯
薬剤併用療法とは、2種類以上の薬剤を組み合わせて行う治療法であり、単剤療法と比較して、より高い有効性を発揮したり、個々の薬剤の投与量を少なくしたりすることができます。薬剤併用療法は、がんや高血圧症、心血管疾患、神経疾患、自己免疫疾患など、さまざまな複合疾患に対して実施されています。相乗効果のある薬剤の組み合わせを同定することは、単剤療法では治療が難しい疾患や薬剤が開発されていない疾患の治療に非常に有用です。しかし、医療機関等で保険診療に用いられる医療用医薬品として官報に告示されている(薬価基準に収載されている)品目は約1万3千品目程度あり、可能性のある薬剤の組み合わせは膨大です。また、ヒトの疾患は数千種以上もあるといわれていることから、全ての薬剤の組み合わせの効果を全ての疾患について動物実験や臨床試験で検証するのは非現実的です。そこで、様々な疾患に対して相乗効果のある薬剤の組み合わせを容易に同定するための計算科学的手法の開発が強く求められています。
近年、相乗効果のある薬剤の組み合わせを情報科学的に見つける手法が開発されてきました。しかし、先行研究の計算手法は、特定の疾患に関してのみ予測が可能といった汎用性の低さや、予測精度の低さが課題でした。
■ 研究の内容
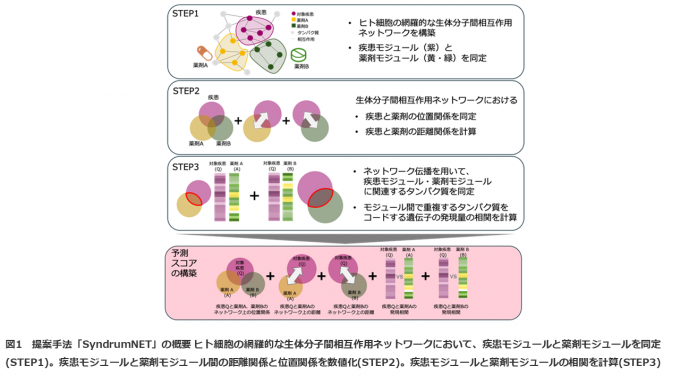
本研究では、相乗効果のある薬剤の組み合わせを予測する計算手法「SyndrumNET:the synergistic drug combination by network-based trans-omics approach」を開発しました。まず、ヒトの生体分子間相互作用において、疾患に関連するタンパク質群(疾患モジュール)と薬剤応答に関連するタンパク質群(薬剤モジュール)を同定しました(図1 STEP1)。さらに、生体分子間相互作用ネットワークにおける疾患―薬剤モジュール間の距離と薬剤―薬剤モジュール間の距離を計算することで、疾患と薬剤ペアの細胞内での距離関係と位置関係を数値化しました(図1 STEP2)。また、疾患モジュールと薬剤モジュールで重複するタンパク質を対象に、それらのタンパク質をコードする遺伝子の遺伝子発現量相関を計算しました(図1 STEP3)。しかし、モジュール間で重複するタンパク質はほとんどなく、遺伝子発現量の相関が計算できないという問題点がありました。そこで、本研究では、ネットワーク伝播と呼ばれるネットワーク科学のアルゴリズムを用いることで、疾患モジュール?薬剤モジュールそれぞれに関連するタンパク質の情報を生体分子間相互作用ネットワーク上で伝播させることで、疾患モジュールと薬剤モジュールで重複するタンパク質の数を増加させ、モジュール間の遺伝子発現量相関の計算を可能としました。そして、細胞内における疾患と薬剤の位置関係、距離関係、相関関係の情報を統合した予測スコアを構築し、相乗効果のある薬剤の組み合わせを予測する計算手法を開発しました(図1 予測スコアの構築)。
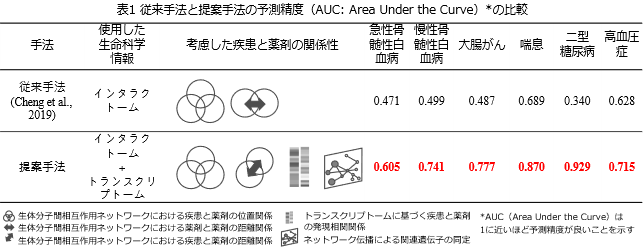
次に、1,488薬剤(1,106,328の薬剤ペア)から、急性骨髄性白血病、慢性骨髄性白血病、大腸がん、喘息、二型糖尿病、高血圧症の6つの疾患に対する相乗効果のある薬剤の組み合わせの予測を行い、既知の組み合わせの再現という視点から精度を従来手法と比較しました。予測精度はAUC(Area Under the Curve)で評価しました。AUCは1に近いほど予測精度が良いことを示します。この結果、提案手法の予測精度は0.605~0.929となり、従来のシングルオミックス情報のみを用いる手法よりも、平均で約58%、最高で約170%の予測精度の向上が見られました(表1)。
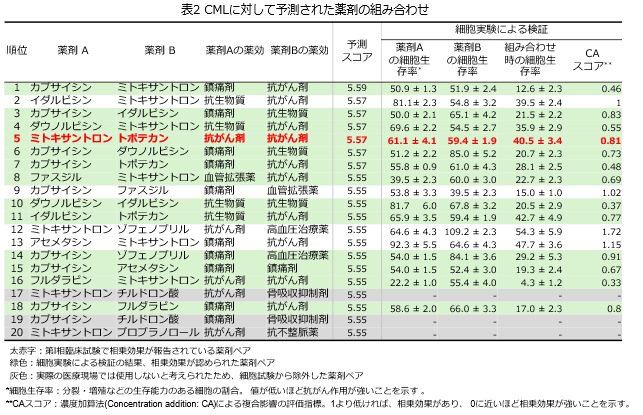
新規の薬剤組み合わせを発見するため、提案手法を用いて、慢性骨髄性白血病に対して相乗効果が高い薬剤ペアの予測を行いました(表2)。その結果、ミトキサントロンとカプサイシンの組み合わせなどが新規に予測されました。新規に予測された薬剤ペアの慢性骨髄性白血病細胞株に対する抗がん作用を徳島大の研究チームが細胞実験により検証しました(表2)。この結果、実験に供した17の薬剤ペアのうち、13薬剤ペアで相乗的な抗がん効果が確認されました。
最後に、相乗効果が発揮された分子メカニズムを理解するために、最上位に予測された薬剤ペアであるミトキサントロンとカプサイシンを慢性骨髄性白血病細胞株に投与した時の、トランスクリプトーム解析を行いました(図2)。この結果、カプサイシンとミトキサントロンを組み合わせて投与した時のみに、Ras1シグナル伝達経路関連遺伝子群(THBS1, RASGRP3, PDGFB)の遺伝子発現が顕著に上昇していました(図2 上)。Ras1シグナル伝達経路は白血球の遊走や腫瘍の進行に重要な役割を持つことが明らかとなっているシグナル伝達経路です。そこで、これらの遺伝子の上流解析を行ったところ、転写因子SCL (stem cell leukemia gene) が3つの遺伝子の発現制御に関与することが明らかとなりました。これらのことから、カプサイシンとミトキサントロンという2つの薬剤は、転写因子SCLを介してRap1シグナル伝達経路関連遺伝子発現上昇を引き起こし、慢性骨髄性白血病細胞株の増殖を強く抑制したと考えられました(図2 下)。
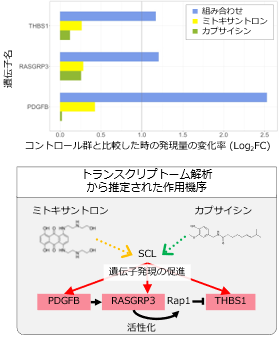
図2 トランスクリプトーム解析の結果
■ 今後の展開
本研究では、相乗効果を有する薬剤の組み合わせを予測する新しい計算手法を開発しました。提案手法は、多様な視点の生命情報を用いる点が特長です。今後、より多くの情報を加えることで、精度の向上が見込まれます。また、提案手法では、治療効果に焦点を当て予測手法を構築しましたが、副作用に焦点を当て予測手法を構築することも可能です。将来的に、本研究で提案した治療効果を予測する手法と副作用を予測する手法を組み合わせることで、治療効果が高く副作用が低い薬剤の組み合わせ手法を開発する予定です。本研究ではカプサイシンとミトキサントロンという2つの薬剤がどのようにしてRap1シグナル伝達経路関連遺伝子やその上流の転写因子と相互作用するかまでは明らかとなっていません。今後、薬剤と遺伝子の相互作用を詳細に調査することで、相乗効果を発揮するメカニズムの詳細が解明されることが望まれます。
本研究は、内藤記念科学振興財団 内藤記念女性研究者研究助成「トランスクリプトーム情報と生体分子間相互作用ネットワークを用いた薬剤の組み合わせ効果の予測」(研究代表者:飯田緑)、JSPS科学研究費基金?特別研究員奨励費(RPD)JP22KJ2496「タンパク質間相互作用ネットワークと遺伝子発現情報を統合して薬剤の組合せを予測する」(研究代表者:飯田緑)、JSPS科学研究費基金?基盤研究(C) JP22K12265「ネットワーク生物学と機械学習によって生物種横断的に化学物質の複合影響を予測する」(研究代表者:飯田緑)、JSPS科学研究費補助金?学術変革領域研究(B)JP20H05797「シナシ?ー効果を有する化合物群のAI による探索と設計」(研究代表者:山西芳裕)、JP20H05799「シナジー効果の評価系構築と薬理的検証」(研究代表者:合田光寛)、20B402「シナジー創薬学」(研究代表者:山西芳裕)の支援を受け行われました。
■ 用語解説
※1 相乗効果 : 複数の要素が組み合わさることで、個々の要素の効果を超える効果が生じる現象。
※2 生体分子間相互作用ネットワーク : 細胞内で起こる、タンパク質などの分子間の結合や情報伝達などのこと。
※3 遺伝子発現情報 : 遺伝子がどの程度、mRNAとして発現しているか(活性度)を示す情報。
※4 モジュール間の距離 : 生体分子間相互作用ネットワーク内で、異なるモジュール間の相対的な位置関係を示す指標。
※5 ネットワーク伝播 : ネットワーク内の情報が伝わっていくプロセス。
※6 転写因子:遺伝子の発現を調節する役割を担うDNAに結合するタンパク質。
■ 論文の詳細情報
| タイトル | “A network-based trans-omics approach for predicting synergistic drug combinations” |
| 著者名 | Iida, M., Kuniki, Y., Yagi, K., Goda, M., Namba, S., Takeshita, J., Sawada, R., Iwata, M., Zamami Y., Ishizawa, K. and Yamanishi, Y. |
| 雑 誌 | 「Communications Medicine」 |
| D O I | 10.1038/s43856-024-00571-2. |
【研究内容に関するお問い合わせ先】
国立大学法人 九州工業大学大学院情報工学研究院
物理情報工学研究系 准教授 飯田緑
E-mail: iida.midori*phys.kyutech.ac.jp
TEL: 050-1739-2071
国立大学法人 徳島大学大学院医歯薬学研究部
准教授 合田光寛
E-mail: mgoda*tokushima-u.ac.jp
TEL:088-633-7471
東海国立大学機構 名古屋大学大学院情報学研究科
教授 山西芳裕
E-mail: Yamanishi*i.nagoya-u.ac.jp
TEL: 052-789-5638
【報道に関するお問い合わせ先】
国立大学法人 九州工業大学
経営戦略室(広報?ブランディング担当)
E-mail: pr-kouhou*jimu.kyutech.ac.jp
TEL:093-884-3007
国立大学法人 徳島大学蔵本事務部医学部
総務課総務係
E-mail: isysoumu1k*tokushima-u.ac.jp
TEL: 088-633-9116
東海国立大学機構 名古屋大学
総務部広報課
E-mail: nu_research*t.mail.nagoya-u.ac.jp
TEL: 052-558-9735
(メールは*を@に変えてお送りください)